Всемирный день борьбы с раком: устраняя пробелы в обеспечении онкологической помощи
4 февраля отмечается Всемирный день борьбы с раком, учрежденный Международным союзом по борьбе с онкологическими заболеваниями в 2005 году. Это возможность для мирового медицинского сообщества объединиться для обмена опытом и данными о новых возможностях профилактики, ранней диагностики и лечения онкологических заболеваний, а также для информирования населения. Тема Всемирного дня борьбы с раком в этом в году – «Устраняя пробелы в обеспечении помощи».
В настоящее время онкологические заболевания по-прежнему сохраняют второе место в структуре мировой смертности[1]. По данным Всемирной организации здравоохранения ежегодно во всем мире вследствие них умирает каждый 8-й мужчина и каждая 11-я женщина. По оценкам ученых, к 2040 году число ежегодных новых случаев онкологических заболеваний достигнет 28,4 млн[2].
В России, согласно данным Министерства здравоохранения, по состоянию на начало 2023 г. насчитывалось порядка 4 млн. граждан с онкологическими диагнозами. Число же новых случаев, выявляемых в том числе на ранних стадиях, составляет более 600 тыс. в год. С улучшением диагностики, внедрением инновационных методов лечения и благодаря другим мерам в рамках федерального проекта «Борьба с онкологическими заболеваниями» в период с 2019 по 2023 гг. смертность вследствие онкологических заболеваний в РФ удалось снизить почти на 4,4%[3].
Внедрение современных диагностических процедур и расширение охвата скрининговых мероприятий наряду с информированием населения о методах самодиагностики и профилактики онкологических заболеваний – одни из важнейших факторов успеха в устранении пробелов в оказании онкологической помощи.
Такие пробелы могут быть связаны в том числе с возрастом пациента. Так, около 55% диагностированных случаев рака и 70% летальных исходов приходятся на лиц старше 65 лет[4]. Однако данные исследований свидетельствуют о том, что пожилой возраст пациента ассоциирован с более низкой вероятностью получения качественного лечения и соответственно худшими показателями выживаемости[5].
Другая актуальная проблема – недостаток информации о результатах клинических исследований и данных реальной клинической практики у специалистов здравоохранения. Это затрудняет процесс выработки стратегии лечения, например, в случаях, когда речь идет об отдельных группах пациентов.
Содействие в устранении пробелов в образовании специалистов здравоохранения и развитии технологий диагностики, а также разработка и обеспечение доступа к инновационной терапии злокачественных новообразований на протяжении многих лет является приоритетом международной биофармацевтической компании Pfizer. Ее онкологический портфель включает инновационные препараты и биосимиляры, малые молекулы, конъюгаты моноклональное антитело-препарат и биспецифические моноклональные антитела. В конце прошлого года была завершена сделка по приобретению компании Seagen, специализирующейся на разработке инновационных противоопухолевых препаратов, за счет чего онкологическое направление в Pfizer будет усилено.
Обеспечение доступа пациентов к инновационной терапии, способствующей повышению качества и продолжительности жизни, лежит в основе деятельности компании в России. Для повышения доступности препаратов своего онкологического портфеля для российских пациентов с 2020 г. Pfizer совместно с компанией «Фармстандарт» реализует масштабный локализационный проект. Этот проект является крайне важным как для компании, так и для пациентов и системы здравоохранения в целом, поскольку предусматривает производство инновационных лекарственных препаратов, находящихся под патентной защитой, уже зарекомендовавших себя в практике российских врачей и входящих в клинические рекомендации и стандарты терапии распространенных в России онкологических заболеваний.
На заводе «Фармстандарт-УфаВИТА» в Республике Башкортостан будет осуществляться производство инновационных лекарственных средств Итулси®[6] (палбоциклиб) для лечения рака молочной железы, Ксалкори®[7] (кризотиниб) для терапии рака легкого, Инлита®[8] (акситиниб) для лечения рака почки и Бозулиф®[9] (бозутиниб) для терапии хронического миелолейкоза. На завершающей стадии находится трансфер технологии, осуществляются необходимые регуляторные процедуры по регистрации российского завода в качестве производственной площадки. Выпуск первых коммерческих серий ожидается уже в этом году.
Pfizer стремится устранить пробелы и неравенство в оказании медицинской помощи онкологическим пациентам, чтобы гарантировать, что достижения современной науки доступны каждому. Усилия компании сосредоточены на ускорении разработки передовых решений для продления и улучшения жизней пациентов, страдающих онкологическими заболеваниями, и обеспечении доступа к ним.
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ ИТУЛСИ®
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Итулси
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: палбоциклиб.
Итулси, 75 мг, капсулы
Каждая капсула содержит 75 мг палбоциклиба.
Итулси, 100 мг, капсулы
Каждая капсула содержит 100 мг палбоциклиба.
Итулси, 125 мг, капсулы
Каждая капсула содержит 125 мг палбоциклиба.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Капсулы
4. КЛИНИЧЕСКИЕ ДАННЫЕ
Показания к применению
Препарат Итулси показан для лечения местнораспространенного или метастатического рака молочной
железы положительного по гормональным рецепторам (HR+), отрицательного по рецептору
эпидермального фактора роста человека 2-го типа (HER2-) в комбинации с:
− ингибитором ароматазы в качестве 1-й линии терапии или
− фулвестрантом у пациентов с прогрессированием заболевания после эндокринной терапии.
Режим дозирования и способ применения
Лечение препаратом Итулси необходимо начинать и проводить под наблюдением врача, имеющего опыт в применении противоопухолевых лекарственных препаратов. Препарат Итулси следует принимать внутрь вместе с пищей, приблизительно в одно и то же время каждый день. Капсулы следует проглатывать
целиком (не разжевывая, не разламывая и не открывая их перед проглатыванием). Нельзя принимать капсулы, если они разломаны, имеют трещины или их целостность нарушена иным образом. Рекомендуемая схема приема: 125 мг один раз в сутки в течение 21 дня с последующим перерывом на 7 дней (схема 3/1) (таким образом полный цикл составляет 28 дней). Ингибитор ароматазы в сочетании с
палбоциклибом следует применять в соответствии с режимом дозирования, указанным в инструкции по медицинскому применению конкретного препарата. Фулвестрант в сочетании с палбоциклибом следует применять в дозе 500 мг, внутримышечно в 1, 15, 29 день и далее 1 раз в месяц. Перед началом и во время
комбинированной терапии препаратом Итулси и ингибитором ароматазы/фулвестрантом женщинам в пре- или перименопаузе необходимо назначать агонисты лютеинизирующего гормон-высвобождающего
фактора (ЛГРГ) в соответствии с локальной клинической практикой (см. раздел 4.4 ОХЛП). Мужчинам, получающим комбинированную терапию препаратом Итулси и ингибитором ароматазы, рекомендуется назначать агонисты ЛГРГ в соответствии с локальной клинической практикой.
Пропуск дозы
При развитии рвоты или пропуске дозы не следует принимать дополнительную дозу препарата, а принять
следующую дозу в обычное для нее время.
Модификация дозы
Модификация дозы препарата Итулси рекомендуется с учетом индивидуальной безопасности и переносимости. Лечение некоторых нежелательных реакций может потребовать временного прекращения приема препарата/переноса приема на более поздний срок и/или снижения дозы либо полной отмены препарата в соответствии с графиком снижения дозы, приведенным в ОХЛП (см. разделы 4.4 и 4.8 ОХЛП).
Особые группы пациентов
Для пациентов с легким или умеренным нарушением функции печени (классы А и В по классификации Чайлд-Пью) коррекция дозы не требуется. Рекомендуемая доза препарата Итулси у пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью) составляет 75 мг один раз в сутки по схеме 3/1 (см. раздел 5.2 ОХЛП). Пациентам с почечной недостаточностью легкой, умеренной или тяжелой степени (клиренс креатинина ≥ 15 мл/мин) коррекция дозы не требуется. Доступных данных по применению препарата у пациентов, которым требуется проведение гемодиализа, недостаточно для предоставления каких-либо рекомендаций по дозированию препарата у данной группы пациентов (см.
разделы 4.4 и 5.2 ОХЛП). Для пациентов в возрасте 65 лет и старше коррекция дозы не требуется (см. раздел 5.2 ОХЛП). Безопасность и эффективность препарата Итулси у детей и подростков в возрасте 18 лет и младше не установлены
Противопоказания:
− Гиперчувствительность к палбоциклибу или к любому из вспомогательных веществ, перечисленных в разделе 6.1 ОХЛП.
− Необходимость в проведении гемодиализа (применение при данном состоянии не изучалось).
− Беременность и период грудного вскармливания (надлежащих и строго контролируемых исследований не проводилось).
− Детский возраст до 18 лет (безопасность и эффективность не установлены).
Особые указания и меры предосторожности при применении
Препарат Итулси следует применять с осторожностью: у пациентов с врожденной непереносимостью лактозы, дефицитом лактазы или глюкозо-галактозной мальабсорбцией; у пациентов с умеренным и тяжелым нарушением функции печени; у пациентов с тяжелым нарушением функции почек; у женщин в пре- или перименопаузе; при нейтропении (см. раздел 4.4 ОХЛП).
Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Следует избегать совместного приема палбоциклиба с мощными индукторами и ингибиторами изофермента CYP3A, а также ингибиторами протонной помпы (см. раздел 4.5 ОХЛП).
Фертильность, беременность и лактация
Палбоциклиб не рекомендуется применять у беременных женщин и у женщин детородного возраста, не использующих надежные методы контрацепции. Способность палбоциклиба проникать в женское грудное молоко не установлена. Пациентки, принимающие палбоциклиб, не должны кормить грудью.
Нежелательные реакции
Самыми частыми нежелательными лекарственными явлениями любой степени тяжести у пациентов, получавших палбоциклиб в клинических исследованиях, были нейтропения, лейкопения, инфекции, утомляемость, тошнота, анемия, стоматит, алопеция и диарея (полный перечень нежелательных реакций, отмеченных в ходе клинических исследований, представлен в разделе 4.8 ОХЛП).
Передозировка
Антидот палбоциклиба неизвестен. Медицинская помощь при передозировке препаратом Итулси должна включать общую поддерживающую терапию.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамические свойства
Фармакотерапевтическая группа: противоопухолевые средства, ингибиторы протеинкиназ, ингибиторы
циклин-зависимых киназ (CDK).
Код АТХ: L01EF01.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
Срок годности
3 года
Условия отпуска
Отпускают по рецепту.
Особые меры предосторожности при хранении
Хранить при температуре ниже 30°С.
Регистрационный документ: ЕАЭС РУ ЛП-№(000570)-(РГ-RU) от 14.02.2022
См. полную информацию о препарате в следующих утвержденных документах:
1. Инструкция по медицинскому применению лекарственного препарата Итулси от 22.09.2022.
2. Общая характеристика лекарственного препарата Итулси от 22.09.2022.
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
ИНЛИТА®
Регистрационный номер: ЛП-№(000687)-(РГ-RU)-241022
Международное непатентованное название: акситиниб
Лекарственная форма: таблетки покрытые пленочной оболочкой
Состав
1 таблетка содержит:
Активное вещество: акситиниб 1 мг или 5 мг.
Вспомогательные вещества: микрокристаллическая целлюлоза, лактозы моногидрат, кроскармеллоза натрия, магния стеарат.
Состав оболочки (Опадрай® II Красный 32K15441): гипромеллоза (ГПМЦ 2910/гипромеллоза 15сП), титана диоксид, лактозы
моногидрат, триацетин (глицерина триацетат).краситель железа оксид красный
Фармакотерапевтическая группа: противоопухолевое средство, ингибитор протеинкиназы.
Код АТХ: L01EK01
Показания к применению
Препарат Инлита показан для лечения взрослых пациентов с распространенным почечно-клеточным раком (ПКР) при
неэффективности предшествующей терапии.
Противопоказания
Гиперчувствительность к акситинибу или к любому из вспомогательных веществ.
Способ применения
Акситиниб предназначен для перорального приема. Рекомендуемая доза акситиниба составляет 5 мг внутрь 2 раза в сутки. Таблетки
следует принимать внутрь, 2 раза в сутки, с интервалом между приемами приблизительно 12 часов, вне зависимости от приема пищи. Лечение должно продолжаться до тех пор, пока наблюдается клинический эффект или же до развития неприемлемой токсичности, не поддающейся коррекции приемом дополнительных лекарственных средств или изменением дозы препарата.
Коррекция дозы. В зависимости от индивидуальной переносимости и безопасности суточная доза препарата может быть уменьшена или увеличена. При хорошей переносимости начальной дозы акситиниба 5 мг 2 раза в сутки и отсутствии нежелательных реакций >2 степени (т.е. при отсутствии серьезных нежелательных реакций согласно общим терминологическим критериям нежелательных
явлений [CTCAE], версия 3.0) в течение 2-х последовательных недель можно увеличить дозу препарата до 7 мг 2 раза в сутки за исключением случаев, когда артериальное давление превышает 150/90 мм рт. ст. или пациент получает антигипертензивную
терапию. Впоследствии, руководствуясь этими же критериями, при хорошей переносимости дозы акситиниба 7 мг 2 раза в сутки можно увеличить дозу препарата до максимальной дозы ‒ 10 мг 2 раза в сутки.Для коррекции некоторых нежелательных реакций может потребоваться временная или постоянная отмена и/или снижение дозы акситиниба. При необходимости снижения дозы акситиниба ее можно снизить до 3 мг 2 раза в сутки и затем еще ‒ до 2 мг 2 раза в сутки.
Особые указания и меры предосторожности при применении
Сердечная недостаточность. Симптомы и признаки сердечной недостаточности необходимо контролировать на протяжении всего
периода лечения акситинибом. Лечение сердечной недостаточности может потребовать временного или полного прекращения
терапии и/или уменьшения дозы акситиниба.
Артериальная гипертензия. Перед началом терапии акситинибом необходимо тщательно откорректировать артериальное давление.
Необходимо контролировать состояние пациентов на предмет развития артериальной гипертензии и при необходимости проводить
стандартную антигипертензивную терапию. В случае развития стойкой артериальной гипертензии, не поддающейся
антигипертензивной терапии, дозу акситиниба следует снизить. При развитии тяжелой артериальной гипертензии у пациентов
рекомендуется временно прекратить терапию акситинибом до стабилизации артериального давления, после чего терапию
акситинибом можно возобновить с назначением препарата в более низкой дозе.
Артериальная тромбоэмболия. Следует с осторожностью применять акситиниб у пациентов с факторами риска развития данных
явлений или имеющих подобные эпизоды в анамнезе. Исследования применения акситиниба у пациентов, перенесших
артериальную тромбоэмболию в предшествующие 12 месяцев, не проводились.
Венозная тромбоэмболия. Следует с осторожностью применять акситиниб у пациентов с факторами риска развития данных явлений
или имеющих подобные эпизоды в анамнезе. Исследования применения акситиниба у пациентов, перенесших венозную
тромбоэмболию в предшествующие 6 месяцев, не проводились.
Оценка уровня гемоглобина или гематокрита. Рекомендуется проводить мониторинг уровня гемоглобина или гематокрита до
начала лечения, а также периодически в процессе лечения акситинибом.
Кровотечения. В клинических исследованиях акситиниба наблюдались случаи развития кровотечений.
Аневризмы и расслоения артерий. До начала лечения препаратом Инлита, необходимо тщательно оценить возможные риски у
пациентов, имеющих такие факторы риска как гипертензия или наличие аневризмы в анамнезе.
Исследования применения акситиниба у пациентов с признаками метастатического поражения головного мозга, по поводу которого не осуществлялось соответствующего лечения, не проводились, в связи с чем не следует применять акситиниб у данной категории пациентов.
Исследования применения акситиниба у пациентов, недавно перенесших желудочно-кишечное кровотечение, не проводились; в связи с чем не следует применять акситиниб у данной категории пациентов.
Осложнения при заживлении ран. Лечение акситинибом должно быть прекращено как минимум за 24 часа до проведения планового оперативного вмешательства.
Нарушение функции печени. При назначении акситиниба пациентам с печеночной недостаточностью средней степени (класс B по Чайлд-Пью) рекомендуется снижать дозу акситиниба. Применение акситиниба у пациентов с печеночной недостаточностью
тяжелой степени (класс C по Чайлд-Пью) не изучалось, поэтому препарат не следует применять у данной категории пациентов.
Нежелательные реакции
Наиболее частыми (≥20%) нежелательными реакциями, наблюдавшимися при лечении акситинибом, были диарея, артериальная гипертензия, утомляемость, снижение аппетита, тошнота, снижение массы тела, дисфония, синдром
ладонно-подошвенной эритродизестезии (ладонно-подошвенный синдром), кровотечение, гипотиреоз, рвота, протеинурия, кашель и запор. Следующие нежелательные реакции отмечались часто (≥1 % и <10 %) и очень часто (≥10 %):
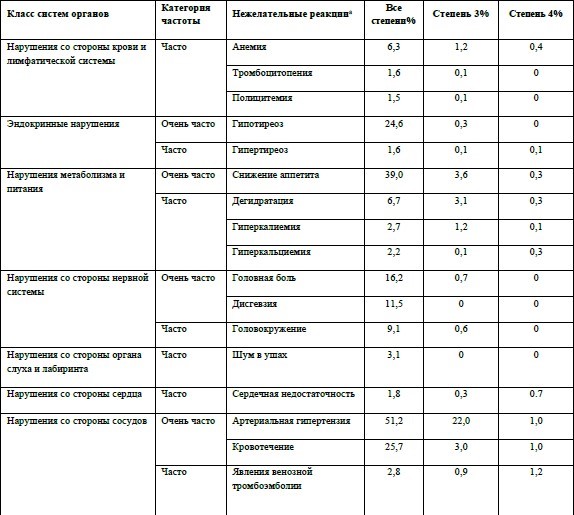
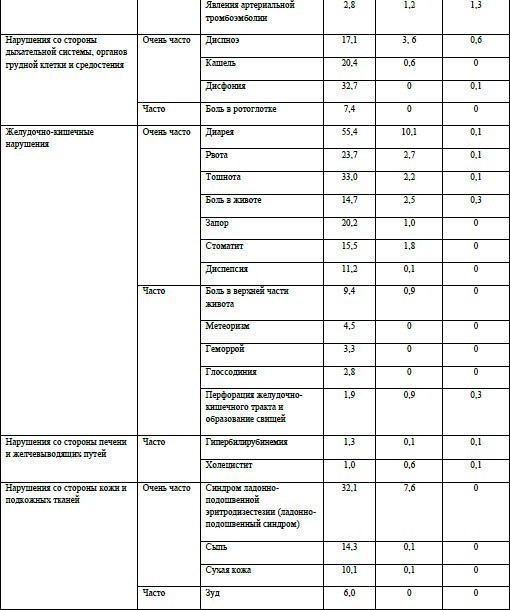
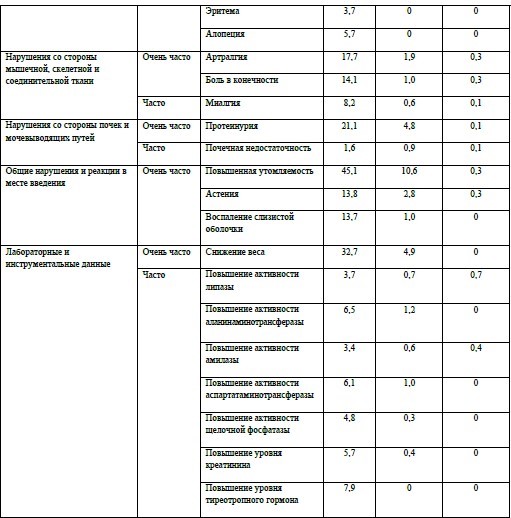
Передозировка Специфического лечения при передозировке акситиниба не существует. В случае подозрения на передозировку следует временно прекратить прием акситиниба и провести поддерживающее лечение.
Влияние на способность управлять транспортными средствами и работать с механизмами
Инлита оказывает несущественное влияние на способность управлять транспортными средствами и работать с механизмами. Пациентов следует предупредить о возможности развития во время лечения акситинибом некоторых нежелательных явлений, и, в частности, головокружения и/или усталости.
Ссылка: Общая характеристика лекарственного препарата ИНЛИТА® (Регистрационное удостоверение лекарственного препарата Инлита ЛП-№(000687)-(РГ-RU)-241022 от 24.10.2022 г.)
Краткая инструкция по медицинскому применению лекарственного препарата КСАЛКОРИ®
Регистрационный номер: ЛП-№(002125)-(РГ-RU)
Международное непатентованное название: кризотиниб
Лекарственная форма: капсулы
Фармакотерапевтическая группа: противоопухолевые средства; ингибиторы протеинкиназ; ингибиторы киназы анапластической лимфомы (ALK)
Код АТХ: L01ED01
Показания к применению
Препарат Ксалкори показан к применению у взрослых в виде монотерапии:
• в качестве терапии первой линии у пациентов с ALK (anaplastic lymphoma kinase) —позитивным распространенным немелкоклеточным раком легкого (НМРЛ).
• для применения у пациентов, получавших ранее лечение по поводу ALK-позитивного распространенного немелкоклеточного рака легкого (НМРЛ).
• для применения у пациентов с ROS1-позитивным распространенным немелкоклеточным раком легкого (НМРЛ).
Противопоказания
Гиперчувствительность к кризотинибу или к любому из вспомогательных веществ.
Способ применения и дозы
Режим дозирования и способ применения
Лечение препаратом Ксалкори должно начинаться и осуществляться под наблюдением врача, имеющего опыт применения противоопухолевых лекарственных препаратов.
Анализ экспрессии ALK и ROS1
Для отбора пациентов на лечение препаратом Ксалкори необходимо использовать точный валидированный метод оценки экспрессии гена ALK или ROS1. Определение позитивного статуса ALK или ROS1 НМРЛ должно проводиться до начала терапии кризотинибом. Оценка должна проводиться лабораториями, имеющими соответствующий опыт использования специальных технологий
Режим дозирования
Рекомендуемый режим дозирования препарата Ксалкори: 250 мг 2 раза в сутки (суточная доза 500 мг) в непрерывном режиме.
Перед назначением необходимо внимательно изучить полную инструкцию по применению.
Нежелательные реакции
Наиболее серьезными нежелательными реакциями, зарегистрированными у 1722 пациентов с распространенным ALK или ROS1-позитивным НМРЛ, были гепатотоксичность, ИБЛ/пневмонит, нейтропения и удлинение интервала QT (см. раздел 4.4). Самыми частыми нежелательными реакциями (≥ 25 %) у пациентов с ALK или ROS1-позитивным НМРЛ являлись: нарушение зрения, тошнота, диарея, рвота, отек, запор, повышение активности трансаминаз, утомляемость, снижение аппетита, головокружение и нейропатия.
Самыми частыми нежелательными реакциями (с частотой ≥ 3 % при любой причинной обусловленности), приводившими к временному прекращению приема препарата, были нейтропения (11 %), повышение активности трансаминаз (7 %), рвота (5 %) и тошнота (4 %).
Наиболее частыми нежелательными реакциями (с частотой ≥ 3 % при любой причинной обусловленности), приводившими к снижению дозы препарата, были повышение активности трансаминаз (4 %) и нейтропения (3 %). Нежелательные явления при любой причинной обусловленности, приводившие к полной отмене препарата, были отмечены у 302 (18 %) пациентов, из которых самыми частыми нежелательными явлениями (≥ 1 %) были интерстициальная болезнь легких (1 %) и повышение активности трансаминаз (1 %).
Нежелательные реакции, о которых сообщалось в ходе клинических исследований кризотиниба
(n=1722)
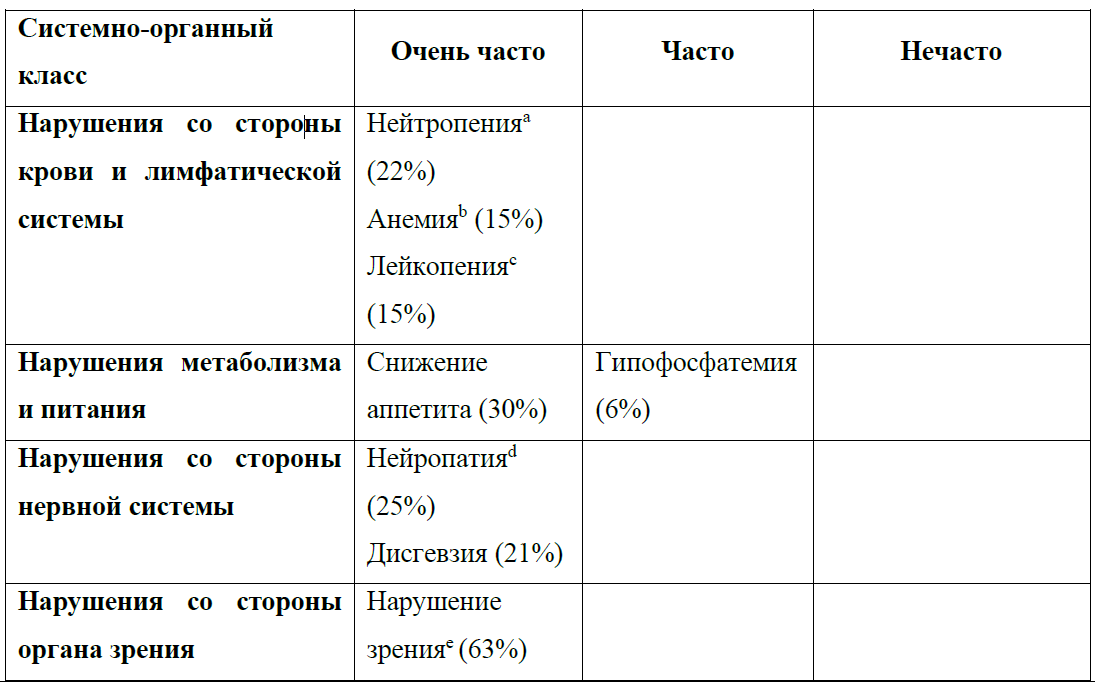
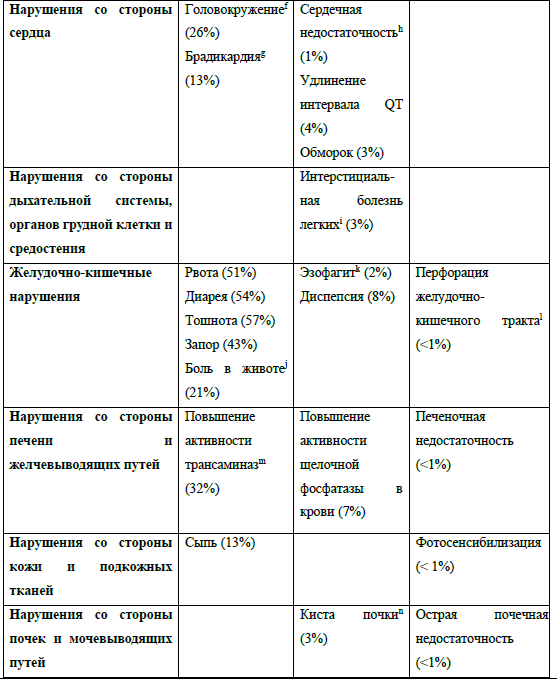
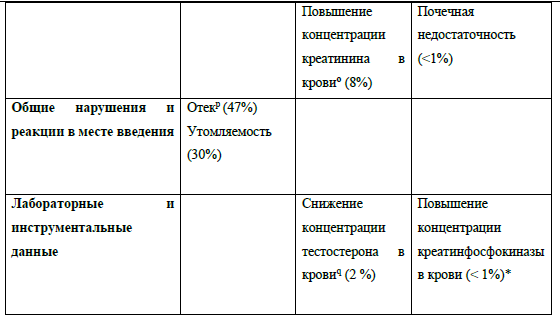
Передозировка
Лечение передозировки кризотинибом должно включать общие поддерживающие меры.
Антидота препарата Ксалкори не существует.
Срок годности: 4 года.
Условия отпуска: отпускают по рецепту.
Особые меры предосторожности при хранении: хранить при температуре ниже 30 °C.
Перед назначением препарата ознакомьтесь с полной инструкцией по медицинскому применению.
(Подготовлено на основе общей характеристики лекарственного препарата Ксалкори® (кризотиниб) утверждена МЗ РФ 13 декабря 2023 г., рег. уд. ЛП-№(002125)-(РГ-RU))
Краткая инструкция по медицинскому применению лекарственного препарата Бозулиф (бозутиниб) таблетки, покрытые пленочной оболочкой 100 мг и 500 мг
Бозулиф (бозутиниб) – противоопухолевое средство, ингибитор протеинтирозинкиназы.
Показания к применению:
• Бозутиниб показан для лечения впервые диагностированного хронического миелолейкоза с положительной филадельфийской хромосомой (ХМЛ Ph+) в хронической фазе (ХФ) у взрослых;
• Бозутиниб показан для лечения хронического миелолейкоза с положительной филадельфийской хромосомой (ХМЛ Ph+) в хронической фазе, фазе акселерации или бластном кризе у взрослых при непереносимости или неэффективности предыдущей терапии хотя бы одним из ингибиторов тирозинкиназ, включая иматиниб, нилотиниб или дазатиниб.
Противопоказания:
- гиперчувствительность к бозутинибу или к любому вспомогательному веществу, входящему в состав препарата;
- следует избегать одновременного применения с мощными или умеренными ингибиторами или индукторами изофермента CYP3A (см. раздел «Взаимодействие с другими лекарственными препаратами»);
- беременность, период грудного вскармливания;
- детский возраст до 18 лет (недостаточно данных по безопасности и эффективности).
С осторожностью:
Следует с осторожностью применять бозутиниб одновременно со слабыми ингибиторами или индукторами изофермента CYP3A, субстратами P-гликопротеина (P-gp), ингибиторами протонной помпы (ИПП).
Следует соблюдать осторожность при применении бозутиниба у пациентов с аритмиями в анамнезе или с факторами, предрасполагающими к удлинению интервала QTc, с неконтролируемыми или тяжелыми сердечно-сосудистыми заболеваниями, включая недавно перенесенный инфаркт миокарда, застойную сердечную недостаточность, нестабильную стенокардию или клинически выраженную брадикардию и у пациентов, принимающих лекарственные средства, которые могут вызвать удлинение интервала QT (например, антиаритмические препараты и другие вещества, которые могут вызвать удлинение интервала QT (см. раздел «Взаимодействие с другими лекарственными препаратами»), а также у пациентов с нарушением функции желудочно-кишечного тракта (недавние состояния или острые).
Способ применения и дозы
Рекомендуется принимать бозутиниб внутрь, 1 раз в сутки, во время приема пищи. Прописанную дозу препарата необходимо принимать каждый день в одно и тоже время. Терапию бозутинибом следует продолжать до прогрессирования заболевания или развития непереносимости к терапии.
В случае пропуска дозы более чем на 12 часов не следует принимать дополнительную дозу препарата; необходимо принять обычную назначенную дозу на следующий день.
Впервые диагностированный ХМЛ Ph+ в хронической фазе
Рекомендуемая доза бозутиниба составляет 400 мг внутрь, 1 раз в сутки, во время приема пищи.
ХМЛ Ph+ в хронической фазе, фазе акселерации или бластном кризе при непереносимости или неэффективности предыдущей терапии
Рекомендуемая доза бозутиниба составляет 500 мг внутрь, 1 раз в сутки, во время приема пищи.
Перед назначением необходимо внимательно изучить полную инструкцию по применению.
Побочное действие: частота нежелательных реакций представлена по следующей классификации: очень частые (≥10%), частые (≥1 % и <10 %), нечастые (≥0,1 % и <1 %), редкие (≥0,01 % и <0,1 %), очень редкие <0,01 %
Инфекционные и паразитарные заболевания: очень частые – инфекция дыхательных путей (в том числе инфекции нижних дыхательных путей, инфекции дыхательных путей, вирусные инфекции дыхательных путей, инфекции верхних дыхательных путей, вирусные инфекции верхних дыхательных путей), назофарингит; частые – пневмония (в том числе атипичная пневмония, пневмония, пневмония бактериальная, пневмония грибковая, пневмония некротизирующая, пневмония стрептококковая), грипп (в том числе грипп H1N1, грипп), бронхит.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечастые – синдром лизиса опухоли.
Нарушения со стороны крови и лимфатической системы: очень частые – тромбоцитопения (в том числе снижение количества тромбоцитов, тромбоцитопения), анемия (в том числе анемия, снижение гемоглобина, снижение количества эритроцитов), нейтропения (в том числе нейтропения, снижение количества нейтрофилов); частые – лейкопения (в том числе лейкопения, снижение количества лейкоцитов); нечастые – фебрильная нейтропения, гранулоцитопения.
Нарушения со стороны иммунной системы: частые – лекарственная гиперчувствительность; нечастые – анафилактический шок.
Нарушения со стороны обмена веществ и питания: очень частые – снижение аппетита; частые – гиперкалиемия (в том числе повышение уровня калия в крови, гиперкалиемия), гипофосфатемия (в том числе понижение уровня фосфора в крови, гипофосфатемия), дегидратация.
Нарушения со стороны нервной системы: очень частые – головная боль, головокружение; частые – дисгевзия.
Нарушения со стороны органа слуха и лабиринтные нарушения: частые – звон в ушах.
Нарушения со стороны сердца: частые – перикардиальный выпот; нечастые – перикардит.
Нарушения со стороны сосудов: частые – гипертензия* (в том числе повышение кровяного давления, повышение систолического давления, эссенциальная гипертензия, гипертензия, гипертонический криз).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень частые – диспноэ, плевральный выпот; частые – дыхательная недостаточность, легочная гипертензия (в том числе легочная артериальная гипертензия, повышенное легочное артериальное давление, легочная гипертензия); нечастые – острый отек легких (в том числе острый отек легких, отек легких).
Нарушения со стороны желудочно-кишечного тракта: очень частые – диарея, рвота, боль в животе (в том числе дискомфорт в животе, боль в животе, боль нижней части живота, боль в верхней части живота, болезненность в животе, боль в желудочно-кишечном тракте), тошнота; частые – гастрит, желудочно-кишечное кровотечение (в том числе анальное кровотечение, желудочное кровотечение, желудочно-кишечное кровотечение, кишечное кровотечение, кровотечение из нижних отделов желудочно-кишечного тракта, ректальное кровотечение, кровотечение из верхних отделов желудочно-кишечного тракта), панкреатит острый (в том числе панкреатит, острый панкреатит).
Нарушения со стороны печени и желчевыводящих путей: частые – гепатотоксичность (в том числе гепатит, токсический гепатит, токсическое поражение печени, дисфункция печени), нарушение функции печени (в том числе повышение уровня печеночных ферментов, нарушение функции печени, отклонение от нормы показателей печеночных проб, повышение показателей печеночных проб, повышение активности аминотрансфераз); нечастые – повреждение клеток печени (в том числе лекарственное повреждение клеток печени, гепатоцеллюлярное повреждение, повреждение печени).
Нарушения со стороны кожи и подкожных тканей: очень частые – сыпь (в том числе сыпь, макулезная сыпь, макулопапулезная сыпь, папулезная сыпь, зудящая сыпь); частые – крапивница, кожный зуд, акне; нечастые – полиморфная эритема, эксфолиативная сыпь, лекарственный дерматит; частота неизвестна - синдром Стивена-Джонсона*.
Нарушения со стороны скелетно-мышечной и соединительной ткани: очень частые – боль в суставах, боль в спине; частые – миалгия.
Нарушения со стороны почек и мочевыводящих путей: частые – острая почечная недостаточность, почечная недостаточность, нарушение функции почек.
Общие расстройства и нарушения в месте введения: очень частые – утомляемость (в том числе астения, утомляемость, недомогание), пирексия, отеки (в том числе отек век, отек лица, генерализованный отек, локальный отек, отек, периферический отек, периорбитальный отек); частые – боль в области грудной клетки (в том числе дискомфорт в области грудной клетки, боль в области грудной клетки), боль.
Лабораторные и инструментальные данные: очень частые – повышение активности аланинаминотрансферазы (АЛТ) (в том числе отклонение от нормы показателей АЛТ, повышение активности АЛТ), повышение активности аспартатаминотрансферазы (АСТ), повышение активности липазы (в том числе гиперлипаземия, повышение активности липазы), повышение концентрации креатинина в плазме крови; частые – повышение амилазы в крови (в том числе повышение амилазы в крови, гиперамилаземия), повышение активности гаммаглутамилтранспептидазы (ГГТП), повышение активности креатинфосфокиназы в плазме крови, повышение концентрации билирубина (в том числе повышение концентрации конъюгированного билирубина, повышение концентрации билирубина, повышение концентрации неконъюгированного билирубина крови, гипербилирубинемия) в плазме крови, удлинение интервала QT на электрокардиограмме (ЭКГ) (в том числе удлинение интервала QT на ЭКГ, синдром удлиненного QT, вентрикулярная тахикардия).
* Нежелательные реакции, выявленные в ходе пострегистрационных исследований.
Передозировка
Опыт лечения передозировки бозутиниба в клинических исследованиях ограничен отдельными случаями. Сообщений о развитии серьезных нежелательных явлений, ассоциированных с передозировкой, не поступало. При передозировке бозутиниба необходимо наблюдение пациента и проведение соответствующей поддерживающей терапии.
Срок годности: 4 года.
Условия отпуска: по рецепту.
Условия хранения: хранить при температуре не выше 25 °C. Хранить в недоступном для детей месте.
Производитель
Эксцелла ГмбХ и Ко. КГ, Германия
Адрес: Нюрнбергер Штрассе 12, 90537 Фойхт, Германия
Пфайзер Мэнюфэкчуринг Дойчленд ГмбХ, Германия
Адрес: Моосвальдаллее 1, 79090 Фрайбург, Германия.
Выпускающий контроль качества
Пфайзер Мэнюфэкчуринг Дойчленд ГмбХ, Германия
Адрес: Моосвальдаллее 1, 79090 Фрайбург, Германия.
Претензии потребителей направлять по адресу ООО «Пфайзер Инновации»:
123112 Москва, Пресненская наб., д. 10, БЦ «Башня на Набережной» (Блок С)
Телефон: + 7 (495) 287-5000
Факс: +7 (495) 287-5300/287-5067
Перед назначением препарата ознакомьтесь с полной инструкцией по медицинскому применению.
(Инструкция по медицинскому применению препарата Бозулиф – таблетки 100 мг и 500 мг, утверждена МЗ РФ 13.10.2022 г., рег. уд. ЛП-002711 от 03.08.2022)
[1] What is cancer? World Cancer Day. https://www.worldcancerday.org/what-cancer#whatiscancer
[2] Новости ООН. Онкологические заболевания в 2020 году: 19,3 млн новых случаев и 10 млн летальных исходов. https://news.un.org/ru/story/2020/12/1392562
[3] В России насчитывается около 4 млн человек с онкозаболеваниями. https://tass.ru/obschestvo/16954441
[4] National Cancer Institute (NCI): SEER Cancer Stat Facts: Cancer of Any Site
[5] Cassidy RJ, Zhang X, Switchenko JM, Patel PR, Shelton JW, Tian S, Nanda RH, Steuer CE, Pillai RN, Owonikoko TK, Ramalingam SS, Fernandez FG, Force SD, Gillespie TW, Curran WJ, Higgins KA. Health care disparities among octogenarians and nonagenarians with stage III lung cancer. Cancer. 2018 Feb 15;124(4):775-784. doi: 10.1002/cncr.31077. Epub 2018 Jan 8. PMID: 29315497; PMCID: PMC5801133.
[6] Итулси ®. Инструкция по применению лекарственного препарата. https://webfiles.pfizer.com/file/7d013a42-97b1-4173-8982-18fb70462144
[7] Ксалкори ®. Инструкция по применению лекарственного препарата
[8] Инлита ®. Инструкция по применению лекарственного препарата
[9] Бозулиф ®. Инструкция по применению лекарственного препарата
Материал предоставлен www.cros.ru









